¤
1. Modèle de l'eau à l'état liquide. |
|
| La plupart des corps sont formés de petits éléments, tous identiques, qui déterminent leurs propriétés physiques et chimiques : les molécules. | |
Pour modéliser les molécules d'un liquide,
on peut envisager de les représenter par un sac de sable
ou par un sac de billes.
Le sable prend la forme du récipient qui le contient.
Le sable se transvase sans problème d'un récipient
à un autre. Les billes s'écoulent parfaitement
lorsqu'on les transvase. |
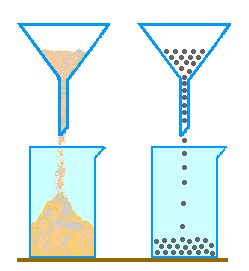 |
| Le sac de billes paraît être le modèle le plus adapté pour représenter l'eau liquide. | |
¤
2. Vaporisation et évaporation de l'eau. |
| L'eau abandonnée dans une soucoupe
disparaît au bout de quelques jours : elle s'est évaporée. La même quantité d'eau abandonnée dans une soucoupe sur le radiateur se vaporise en quelques heures. La même quantité d'eau portée à ébullition se vaporise en quelques minutes. La vaporisation de l'eau se produit sous l'effet de l'énergie apportée par la chaleur. Au niveau des molécules, l'échange de chaleur se traduit par une augmentation de l'agitation qui permet à certaines molécules, proches de la surface, de quitter l'eau liquide : c'est l'évaporation qui se produit à toute température. |
¤
3. Chaleur et changement d'état. |
|
| Les molécules sont désormais représentées par de petites sphères pratiquement jointives, qui s'agitent plus ou moins sous l'effet de la chaleur. | |
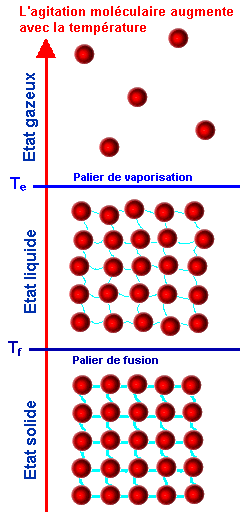 |
L'eau à l'état gazeux ne possède pas de
forme propre. — A température normale, les molécules sont pratiquement jointives :
L'eau à l'état liquide possède un volume propre.
— Les billes qui représentent les molécules sont dans
un récipient. Les billes sont pratiquement bloquées, même
au voisinage de la surface.
|
¤
|
|
En fait on peut montrer que température, volume et pression sont aussi la traduction à notre échelle du degré d'agitation des molécules. |
|
¤
